一、项目名称:广东省医疗器械注册申报人员登记
二、项目内容:广东省医疗器械注册申报人员登记
三、设定的法律依据:
1、《医疗器械注册管理办法》(总局令第4号)
2、《体外诊断试剂注册管理办法》(总局令第5号)
3、关于印发《广东省食品药品监督管理局关于进一步加强医疗器械注册申报人员管理的指导意见》的通知
四、数量及方式:无数量限制。
方式: 申报人在广东省食品药品监督管理局网上填报申请材料,省局在网上受理后,委托广东省执业药师注册中心对资料进行审核,省局对不符合要求的驳回,符合要求的在网上告知,由申报人自行打印登记凭证。
五、办理条件:
申请登记的注册申报人员应为企业的在职在岗员工,且具备以下条件:
1、诚实守信、遵纪守法;
2、具有相应的专业知识。医疗器械相关专业大学专科以上学历的,应具有1年以上(含1年)从事医疗器械注册相关工作经验;非医疗器械相关专业的,应具有3年以上(含3年)从事医疗器械注册相关工作经验;
3、熟悉医疗器械注册的法律、法规、规章和技术要求;
4、具备良好的组织、沟通和协调能力,具备能够指导或监督企业相关部门按规定实施医疗器械注册的专业技能和解决实际问题的能力;
5、具备较强的学习能力,能及时掌握医疗器械注册政策和产品的最新动态。
六、申请材料目录:
资料编号1、医疗器械相关专业知识教育的最高学历、学习经历证书、身份证复印件等证明材料;
资料编号2、从事医疗器械注册相关的医疗器械研制、临床研究、医疗器械生产工作经历证明材料;
资料编号3、近1年内接受至少一次省级以上(含省级)机构组织的医疗器械注册方面的培训情况及证明材料;
资料编号4、广东省医疗器械注册专员授权委托书.doc;
资料编号5、《广东省医疗器械注册专员登记表.doc》(含大一寸证照相片)。
七、申请材料要求:电子版(要求不超过2M)
八、登记受理机关:广东省食品药品监督管理局
受理地点:广东省食品药品监督管理局网站(http://www.gdda.gov.cn/),登录“企业网上办事平台(http://219.135.157.143)”进行网上申报工作(新用户注册时请选择个人用户进行注册),填写并上传申请材料(网上申报操作指引.pdf)。
(注:递交业务和受理、登记均在网上进行。)
九、登记接收机关:广东省食品药品监督管理局
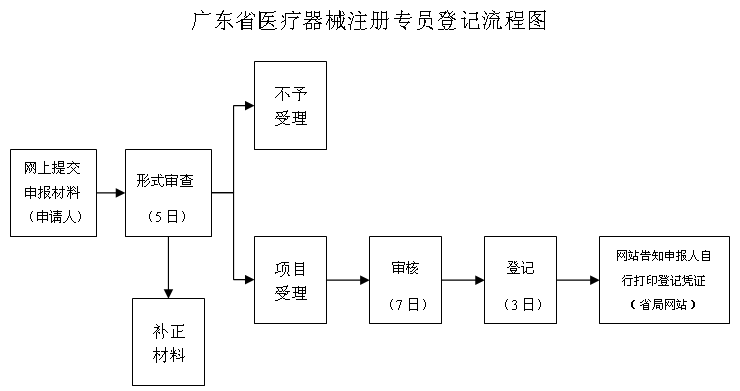
十、办理时限:
自受理之日起,10日内作出决定;自登记之日起10日内在省局网站上查询登记情况。
以上时限不包括申请人补正材料所需的时间。
十一、有效期限:注册专员须每年接受不少于10学时的医疗器械相关业务培训,并在每年1月底之前将上一年度的培训证明提交至医疗器械注册专员管理平台。逾期未提交的,管理平台将不再保留其登记信息。
十二、收费:无
十三、年审或年检:每年1月底之前将上一年度的培训证明提交至医疗器械注册专员管理平台。
十四、咨询与投诉机构:
咨询:广东省执业药师注册中心 020-3788366
投诉:广东食品药品监督管理局政策法规处
注:以上期限以工作日计算,不含法定节假日







